|
Online Microscale Chem.Experiment 5 |
金属イオンの反応 |
芝原寛 泰・川本公二 |
 Home|準備|解説 |実験方法
1, 2, 3 |結果|参考資料|実
験リスト|
Home|準備|解説 |実験方法
1, 2, 3 |結果|参考資料|実
験リスト||
Online Microscale Chem.Experiment 5 |
金属イオンの反応 |
芝原寛 泰・川本公二 |
 Home|準備|解説 |実験方法
1, 2, 3 |結果|参考資料|実
験リスト|
Home|準備|解説 |実験方法
1, 2, 3 |結果|参考資料|実
験リスト|
|
実 験 1 金属イオンの反応 |
|
実 験 2 未知試料の分析 |
|
実 験 3 自由課題 (SPP/ICUにおける高校生の実験から) |
|
実験の準備 |
|
|
金属イオンの分析 |
|
|
8組作成 |
|
|
|
|
購 入 |
入手法 |
|
|
|
|
|
1 |
試薬整理箱(小型) |
100円ショップで |
|
8 |
個 |
購入 |
|
2 |
マイクロプレート(96ウエルプレート) |
アズワン |
アズワン XJ-0448-230 |
8 |
個 |
50個購入 |
|
3 |
マイクロプレート(12ウエルプレート) |
IWAKI |
|
8 |
個 |
50個購入 |
|
4 |
点眼ビン プチボトル 10ml(赤色) |
中村理科工業 |
12本組 |
7 |
箱 |
|
|
5 |
〃 (青色) |
|
12本組 |
9 |
箱 |
|
|
6 |
〃 (遮光型) |
|
12本組 |
3 |
箱 |
|
|
7 |
濾紙 No2 90 |
東洋ろし |
90mm,1箱100枚 |
1 |
箱 |
|
|
8 |
スクリュー管瓶 ラボランパック |
アズワン |
6ml (1箱100本入) |
1 |
箱 |
|
|
9 |
固形硫化水素粉末 |
関東化学 |
500g |
1 |
本 |
|
|
10 |
小さな洗濯ハサミ(色違い 2種) |
100円ショップで |
濾紙固定用 |
8x2 |
個 |
|
|
11 |
プラスチック製楊子(30 本) |
100円ショップで |
ウエル撹拌用 |
8x2 |
個 |
|
|
12 |
丸ラベル(白) |
|
200枚必要 |
1 |
個 |
|
|
13 |
あらざん、ハンダ、ホカロン、スチールウール、線香花火、エナメル 線、その他 |
|
自由課題用 |
|
|
購入 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
調製/作成 |
|
|
|
|
|
|
1 |
0.2mol/L AgNO3 A |
遮光型 橙キャッププチボトル(10mL) |
元溶液を100mLつくり |
8 |
本 |
調製 |
|
2 |
0.2mol/L Pb(NO3)2 B |
赤キャップ プチボトル(10mL) |
5mLづつに分ける |
8 |
本 |
調製 |
|
3 |
0.2mol/L Cu(NO3)2 C |
赤キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
4 |
0.2mol/L Cd(NO3)2 D |
赤キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
5 |
0.2mol/L Fe(NO3)3 E |
赤キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
6 |
0.2mol/L Al(NO3)3 F |
赤キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
7 |
0.2mol/L Zn(NO3)2 G |
赤キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
8 |
0.2mol/L Ba(NO3)2 H |
赤キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
|
|
|
|
|
|
|
|
9 |
2mol/L HCl 1 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
10 |
0.5mol/L K2CrO4 2 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
11 |
1mol/L NH3 3 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
12 |
6mol/L NH3 4 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
13 |
1mol/L NaOH 5 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
14 |
6mol/L NaOH 6 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
15 |
0.1mol/L Na2CO3 7 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
16 |
1mol/L H2SO4 8 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
17 |
0.1mol/L KSCN 9 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
18 |
0.1mol/L K4[Fe(CN)6] 10 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
19 |
0.1mol/L K3[Fe(CN)6] 11 |
遮光型 橙キャッププチボトル(10mL) |
|
8 |
本 |
調製 |
|
20 |
2mol/L HNO3 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
21 |
H2S水 12 |
青キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
22 |
未知試料X 5mL |
赤キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
23 |
未知試料Y 5mL |
赤キャップ プチボトル(10mL) |
|
8 |
本 |
調製 |
|
24 |
硫化水素水をつくるため の,試験管,試験管ばさみ,ゴム栓,ガラス管,ゴム管 |
|
|
|
|
用意 |
 ▲ A〜Hの金属イオン溶液 と 1−12の陰イオン溶
液の収納箱
▲ A〜Hの金属イオン溶液 と 1−12の陰イオン溶
液の収納箱
|
実 験 1 金属イオンの反応 |
|
<目的> ここでは、8種の金属イオン(Ag+, Pb2+, Cu2+,Cd2+,Fe3+,Al3+, Zn2 +,Ba2+)を定性分析する 。 |
|
実験 方法 |
それぞれ0.2mol/lの金属イオンを含む水溶液(A〜H)3滴に、陰イオンを含む溶液等(1−12)を下記の指示に
従って加える。
※ただし,【 】内はPSセル番号を示す。
少量とは1mol/lの溶液を1滴、多量とは 6mol/lの溶液を2滴程度
|
〔1列〕HClの反応 |
PSセル番号 |
|
(1) Ag+ に2mol/l-HCl 1滴を加える。 |
【A1】 |
|
(2) Pb2+に2mol/l-HCl 1滴を加える。 |
【B1】 |
|
〔2列〕K2CrO4の 反応 |
. |
|
(3) Ag+ に0.5mol/l-K2CrO4 1滴を加え る。 |
【A2】 |
|
(4) Pb2+に0.5mol/l-K2CrO4 1滴を加え る。 |
【B2】 |
|
(5) Ba2+に0.5mol/l-K2CrO4 1滴を加え る。 |
【H2】 |
|
〔3列〕NH3水(少量)の反応 |
. |
|
(6) Ag+ に1mol/l-NH3水 1滴を加える。 |
【A3】 |
|
(7) Pb2+に1mol/l-NH3水 1滴を加える。 |
【B3】 |
|
(8) Cu2+に1mol/l-NH3水 1滴を加える。 |
【C3】 |
|
(9) Cd2+に1mol/l-NH3水 1滴を加える。 |
【D3】 |
|
(10 )Fe3+ に1mol/l-NH3水 1滴を加える。 |
【E3】 |
|
(11) Al3+ に1mol/l-NH3水 1滴を加える。 |
【F3】 |
|
(12) Zn2+に1mol/l-NH3水 1滴を加える。 |
【G3】 |
|
〔4列〕NH3水(過剰)の反応 |
. |
|
(13)Ag+ に6mol/l-NH3水 2滴を加える。 |
【A4】←攪拌 |
|
(14)Pb2+に6mol/l-NH3水 2滴を加える。 |
【B4】 |
|
(15)Cu2+に6mol/l-NH3水 2滴を加える。 |
【C4】 |
|
(16)Cd2+に6mol/l-NH3水 2滴を加える。 |
【D4】 |
|
(17)Fe3+ に6mol/l-NH3水 2滴を加える。 |
【E4】 |
|
(18)Al3+ に6mol/l-NH3水 2滴を加える。 |
【F4】 |
|
(19)Zn2+に6mol/l-NH3水 2滴を加える。 |
【G4】←攪拌 |
|
〔5列〕NaOH(少量)の反応 |
|
|
(20)Ag+ に1mol/l-NaOH水溶液 1滴を加える。 |
【A5】 |
|
(21)Pb2+に1mol/l-NaOH水溶液 1滴を加える。 |
【B5】 |
|
(22)Cu2+に1mol/l-NaOH水溶液 1滴を加える。 |
【C5】 |
|
(23)Cd2+に1mol/l-NaOH水溶液 1滴を加える。 |
【D5】 |
|
(24)Fe3+に1mol/l-NaOH水溶液 1滴を加える。 |
【E5】 |
|
(25)Al3+に1mol/l-NaOH水溶液 ※3滴を加える。 |
【F5】※滴数注意 |
|
(26)Zn2+に1mol/l-NaOH水溶液 1滴を加える。 |
【G5】 |
|
〔6列〕NaOH(過剰)の反応 |
. |
|
(27)Ag+ に6mol/l-NaOH水溶液 2滴を加える。 |
【A6】 |
|
(28)Pb2+に6mol/l-NaOH水溶液 2滴を加える。 |
【B6】←攪拌 |
|
(29)Cu2+に6mol/l-NaOH水溶液 2滴を加える。 |
【C6】 |
|
(30)Cd2+に6mol/l-NaOH水溶液 2滴を加える。 |
【D6】 |
|
(31)Fe3+に6mol/l-NaOH水溶液 2滴を加える。 |
【E6】 |
|
(32)Al3+に6mol/l-NaOH水溶液 2滴を加える。 |
【F6】←攪拌 |
|
(33)Zn2+に6mol/l-NaOH水溶液 2滴を加える。 |
【G6】←攪拌 |
|
〔7列〕Na2CO3の 反応 |
. |
|
(34)Ag+ に0.1mol/l-Na2CO3水溶液 1滴 を加える。 |
【A7】 |
|
(35)Pb2+に0.1mol/l-Na2CO3水溶液 1滴 を加える。 |
【B7】 |
|
(36)Ba2+に0.1mol/l-Na2CO3水溶液 1滴 を加える。 |
【H7】 |
|
〔8列〕H2SO4の 反応 |
. |
|
(37)Pb2+に1mol/l-H2SO4 1滴を加える。 |
【B8】 |
|
(38)Ba2+に1mol/l-H2SO4 1滴を加える。 |
【H8】 |
|
〔9列〕KSCNの反応 |
. |
|
(39)Fe3+に0.1mol/l-KSCN水溶液 1滴を加える。 |
【E9】 |
|
〔10列〕K4[Fe(CN)6] の反応 |
. |
|
(40)Cu2+に0.1mol/l-K4[Fe(CN)6]水 溶液 1滴を加える。 |
【C10】 |
|
(41)Fe3+ に0.1mol/l-K4[Fe(CN)6] 水溶液 1滴を加える。 |
【E10】 |
|
〔11列〕K3[Fe(CN)6] の反応 |
. |
|
(42)Fe3+ に0.1mol/l-K3[Fe(CN)6] 水溶液 1滴を加える。 |
【E11】 |
|
〔12列〕H2Sの反応 |
. |
|
(43)Ag+ に2mol/l-HNO3 1滴を加えて酸性にしH2S水 1滴を加え る。 |
【A12】 |
|
(44)Pb2+に2mol/l-HNO3 1滴を加えて酸性にしH2S水 1滴を加え る。 |
【B12】 |
|
(45)Cu2+に2mol/l-HNO3 1滴を加えて酸性にしH2S水 1滴を加え る。 |
【C12】 |
|
(46)Cd2+に2mol/l-HNO3 1滴を加えて酸性にしH2S水 1滴を加え る。 |
【D12】 |
|
(47)Fe3+に2mol/l-HNO3 1滴を加えて酸性にしH2S水 1滴を加え る。 |
【E12】 |
|
(48)Al3+に2mol/l-HNO3 1滴を加えて酸性にしH2S水 1滴を加え る。 |
【F12】 |
|
(49)Zn2+に2mol/l-HNO3 1滴を加えて酸性にしH2S水 1滴を加え る。 |
【G12】 |
|
(50)Ba2+に2mol/l-HNO3 1滴を加えて酸性にしH2S水 1滴を加え る。 |
【H12】 |
|
(51) (47)の操作後に,6mol/l-NH3 1滴を加えて塩基性にする。 |
【E12】 |
|
(52) (49)の操作後に,6mol/l-NH3 1滴を加えて塩基性にする。 |
【G12】 |
実験シート( A〜Hの金属イオン溶液 と 1−12の陰イオン溶液に対応)
96ウエルのマイクロプレートのサイズに合わせて作成する。
(両面/ 裏面は白い沈殿を観察するために背景を黒にしている)。
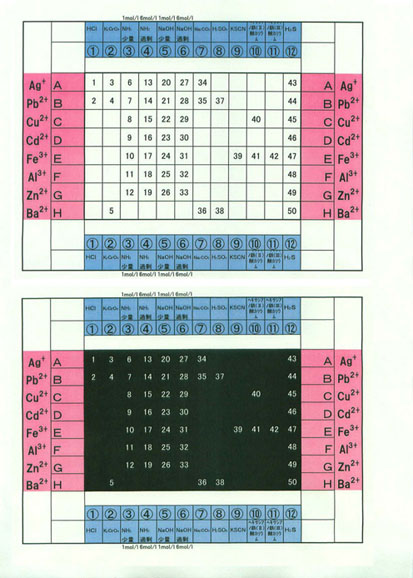
● 実験観察の記録用紙: EXCEL ファイル
|
● 実験結果 金属イオンの分析 |
【結果】
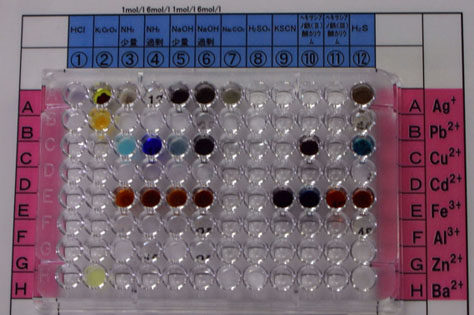
※裏側から観察することもできる(表面張力でこぼれない)。

|
実 験 2 未知試料の分析 |
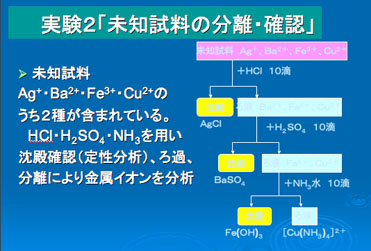
|
実験結果 2 未知試料の分析結果 |
未知試料(金属線)の分析
|
実 験 3 自由課題 (SPP/ICUにおける高校生の実験結果/発表から) |
ここでは、ホッカロン中の金属、未知試料(銅線)、アラザン表面の銀色成分の分析を行う。






▲ HNO3を加える → 溶ける ▲ HClを加 える → 白い沈殿ができる


▲ NH3を過剰に加える → 透明になる
●参考文献: 芝原寛泰 マ イクロスケール実験webpage http://natsci.kyokyo-u.ac.jp/~shiba/microscale/msHirobaOPEN.html